〒734-0036 広島県広島市南区霞1−2−3
TEL. 082-257-5142
SERVICE&PRO蛋
タンパク質リン酸化酵素PKCに関する研究
「PKCについて」
プロテインキナーゼC(以下PKCと略します)は、様々な細胞機能に関与するタンパク質リン酸化酵素で、現在までに10種類以上の分子種の存在が知られています。神経系には、多種多量のPKCが存在し、神経可塑性の発現と維持、神経系の発達、神経細胞の突起伸長と極性の形成などに関与しています。
1. イメージングを駆使したPKCトランスロケーションの研究
PKCは主に細胞質に局在します。しかし、細胞が外界から何らかの刺激を受けた際に、特定の細胞内器官・部位に局在を変えます。この現象は、「PKCのトランスロケーション」と呼ばれており、PKCの際立った特徴の一つです。我々は、PKCと蛍光タンパク質のGFP(Green fluorescent protein)を融合させたPKC-GFPを培養細胞に遺伝子導入し、可視化PKCを発現させ、共焦点レーザー顕微鏡でPKC-GFPのトランスロケーションを観察しました。この細胞に受容体のアゴニストを添加すると、刺激前は細胞質に存在したPKC-GFPが、刺激により素早く細胞膜の方に移動し、また細胞質に戻ってきます(動画1)。このようにPKCは刺激に応じて適切な場所に移動し、その場所でタンパク質のリン酸化を行っていると考えられます。
動画1 受容体刺激によるPKCトランスケーション
| CHO細胞にγPKC-GFPを発現させた。この細胞が持つP2Y受容体をアゴニストのATPで刺激した際のPKCトランスロケーション |
2. PKCの関与する神経変性疾患の病態解明と治療薬の開発に関する研究
遺伝性脊髄小脳失調症14型(SCA14)という稀な遺伝性神経変性疾患は、PKCのγ分子種(γPKC)の遺伝子変異で起こることが知られています。SCA14では小脳プルキンエ細胞死が起こります。SCA14患者から見つかった遺伝子変異を導入したγPKC(変異γPKC)と正常のγPKCがどのように違うか、ともにGFP融合タンパク質を細胞に発現して比較してみました。変異γPKCは、次第に細胞内で凝集体を形成し、細胞死を誘導することがわかりました(図1)。
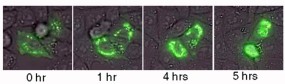 |
変異γPKC-GFPは時間経過とともに凝集体を形成する |
PKCトランスロケーションも変異γPKCと正常のγPKCで比較してみました。変異γPKCは、受容体刺激を加えると一旦細胞膜に行きますが、その後、凝集体を形成することがわかりました(動画2)。これらの結果から、変異γPKCの凝集体を作りやすい性質がSCA14病態発症の鍵を握っていると考えられます。また、多くの神経変性疾患でも、異常なタンパク質が凝集体を作ることがわかっており、SCA14の病態の理解が、神経変性疾患全般の病態解明につながると考えています。変異γPKCの凝集体形成を抑制する薬物は、神経変性疾患の治療薬となる可能性があると考えられます。その候補として、ダイエット甘味料のトレハロースが、変異γPKCの凝集体形成と細胞毒性を抑制することを見つけました。
| CHO細胞に変異γPKC-GFPを発現させ、ATPで刺激した際のPKCトランスロケーション |
主な発表論文
1. Seki, T., Abe-Seki, N., Kikawada, T., Takahashi, H., Yamamoto, K., Adachi,
N., Tanaka, S., Hide, I., Saito, N. and Sakai, N. The effect of trehalose
on the properties of mutant γPKC, which causes spinocerebellar ataxia type
14 (SCA14), in neuronal cell lines and cultured Purkinje cells. J Biol. Chem. 285 (2010) 33252-33264 [PubMed]
2. Seki, T., Shimahara T., Yamamoto, K., Abe, N., Amano, T., Adachi;, N.,
Takahashi, H., Kashiwagi, K., Saito, N. and Sakai, N. Mutant gPKC found
in spinocerebellar ataxia type 14 induces aggregate-independent maldevelopment
of dendrites in primary cultured Purkinje cells. Neurobiol. Dis. 33 (2009) 260-273 [PubMed]
3. Seki, T., Takahashi H., Adachi, N., Abe, N., Shimahara, T., Saito, N. and
Sakai, N. Aggregate formation of mutant protein kinase C gamma found in
spinocerebellar ataxia type 14 impairs ubiquitin proteasome system and
induces endoplasmic reticulum stress. Eur. J. Neurosci. 26 (2007) 3126-3140.
4. Seki, T., Adachi, N., Ono, Y., Mochizuki, H., Hiramoto, K., Amano, T., Matsubayashi, T., Matsumoto, M., Kawakami, H., Saito, N. and Sakai, N. Mutant protein kinase C gamma found in spinocerebellar ataxia type 14 is susceptible to aggregation and causes cell death. J. Biol. Chem., 280 (2005) 29096-29106 [PubMed]
5. Sakai, N., Tsubokawa, H., Matsuzaki,, M., Kajimoto, T., Takahashi, E.,
Ren, Y., Ohmori, S.,Shirai, Y., Matsubayashi, H., Chen, J., Duman, R.S.,
Kasai, H. and Saito, N. Propagation of gPKC translocation along the dendrites
of Purkinje cell in gPKC-GFP transgenic mice. Genes to Cells., 9 (2004) 945-957 [PubMed]
6. Sakai N, Sasaki K, Ikegaki N, Shirai Y, Ono Y, Saito N. Direct visualization of the translocation of the gamma-subspecies of protein kinase C in living cells using fusion proteins with green fluorescent protein, J Cell Biol. 1997 Dec 15;139(6):1465-76. [PubMed]
バナースペース
広島大学大学院 医歯薬保健学研究院
神経薬理学
〒734-0036
広島県広島市南区霞1−2−3
TEL 082-257-5142
FAX 082-257-5144